Con las campañas de vacunación que se están llevando a cabo en todo el mundo para acabar con la pandemia de COVID-19, todos tienen diferentes preguntas sobre las distintas vacunas de COVID-19. A continuación se responden algunas de las preguntas más comunes.
1. ¿Qué vacunas están disponibles para COVID-19?
Siete vacunas COVID-19 están disponibles para el público en más de 75 países a través de varias formas de aprobación y autorización de emergencia. El proceso de aprobación es diferente en todo el mundo, por lo que la disponibilidad de las vacunas dependerá de su lugar de residencia.
Las primeras autorizaciones de vacunas se produjeron en Rusia con la vacuna Sputnik V del Instituto de Investigación Gamaleya y en China con las vacunas de CanSinoBIO, Sinovac y Sinopharm. Estas autorizaciones se produjeron antes de que se completaran grandes ensayos clínicos de fase 3. En la actualidad, en los Estados Unidos están autorizadas dos vacunas de Pfizer/BioNTech y Moderna, y ambas están autorizadas en varios otros países del mundo. La vacuna de AstraZeneca fue aprobada por primera vez en el Reino Unido y desde entonces ha obtenido la autorización en toda Europa y en varios otros países. Las vacunas COVID-19 de Johnson & Johnson y Novavax parecen ser las siguientes en ser autorizadas.
La rápida cobertura de la vacuna en todo el mundo con múltiples opciones de vacunas contra la COVID-19 es un importante objetivo de salud pública. Sin embargo, mientras los suministros de vacunas a nivel mundial sigan siendo limitados, no se puede garantizar la elección de la vacuna aunque se encuentre en un país donde varias vacunas han recibido autorización.
2. ¿Cuáles son las diferencias y similitudes entre las distintas vacunas contra el COVID-19?
La principal diferencia entre las vacunas es si se fabrican a partir de un virus completo (ya sea el SARS-CoV-2 o un vector viral), del material genético del virus (ADN o ARNm) o de partes del virus (subunidad proteica). Las vacunas de Sinovac y Sinopharm son vacunas de virus completo hechas de virus SARS-CoV-2 inactivado. Las vacunas AstraZeneca, Sputnik V, CanSinoBIO y Johnson & Johnson son vacunas vectorizadas con diferentes cepas de adenovirus que codifican el gen de la espiga del SRAS-CoV-2. Las vacunas de Pfizer/BioNTech y Moderna son vacunas de ARNm que llevan instrucciones de ARNm para fabricar la proteína de la espiga del SARS-CoV-2 rodeada en una nanopartícula lipídica. Por último, Novavax será probablemente la primera vacuna de subunidad proteica autorizada para su uso.
Otras diferencias son los esquemas de dosificación y los requisitos de almacenamiento. Por ejemplo, las vacunas de CanSinoBIO y Johnson & Johnson están autorizadas para la administración de una sola dosis, mientras que las otras están autorizadas como una serie de vacunas de dos dosis. Para las vacunas que requieren dos dosis, el intervalo recomendado entre ellas varía de 14 a 56 días. Los requisitos de temperatura de almacenamiento también difieren, ya que la vacuna de Pfizer/BioNTech requiere una temperatura de congelación ultrabaja (menos 70 grados centígrados), lo que dificulta su distribución.
También hay similitudes entre las vacunas actualmente autorizadas para su uso. Todas se administran por inyección intramuscular en el músculo deltoide del brazo. Todas provocan respuestas de anticuerpos y células T, que pueden causar dolor y/o hinchazón en el lugar de la inyección y, a veces, síntomas sistémicos como fiebre, inflamación de los ganglios, mialgia y dolor de cabeza. Los síntomas sistémicos parecen más comunes después de la segunda dosis de la vacuna.
3. ¿Es una vacuna mejor que otra?
Hasta la fecha, no se han realizado comparaciones directas de las vacunas en los ensayos clínicos, y no es justo hacer una comparación de la eficacia de la vacuna basada en ensayos individuales controlados con placebo. Las diferencias en las poblaciones de estudio, las cepas variantes circulantes en los lugares de estudio, los resultados medidos y el momento de la evaluación podrían contribuir a los distintos grados de eficacia de la vacuna, incluso entre los diferentes ensayos de la misma vacuna. La eficacia global de la vacuna notificada en los ensayos de fase 3 publicados en revistas revisadas por pares varía entre el 70 y el 95 por ciento, y se comprobó que cada vacuna evaluada prevenía la enfermedad grave y la muerte relacionada con el COVID-19. (Véase la tabla siguiente para conocer la eficacia notificada de cada una).
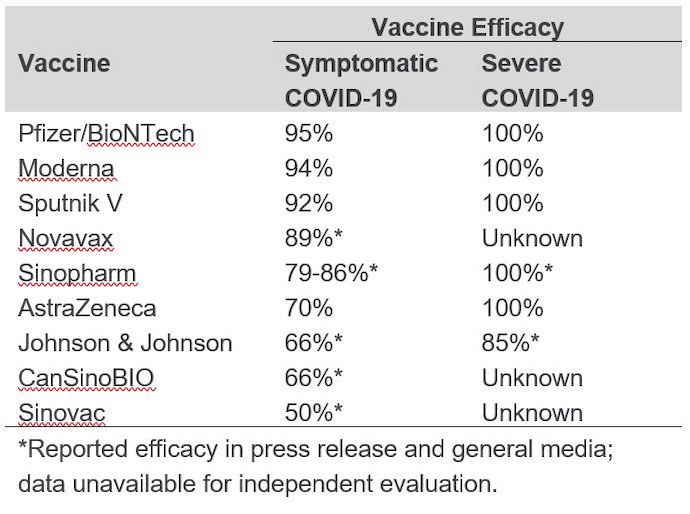
4. ¿Son eficaces las vacunas contra las variantes del SRAS-CoV-2?
La eficacia de las vacunas actualmente autorizadas contra las variantes del virus del SRAS-CoV-2 es un área de investigación activa, y seguimos aprendiendo más cada día. Los primeros estudios sugieren que las vacunas de ARNm de Pfizer/BioNTech y Moderna provocan anticuerpos capaces de neutralizar las variantes circulantes más notables (B.1.1.7, B.1.351 y P.1), aunque los títulos de anticuerpos contra B.1.351 pueden ser más bajos. Sin embargo, los ensayos clínicos realizados en Sudáfrica, donde la variante B.1.351 está muy extendida, parecen indicar que algunas vacunas pueden ser menos eficaces contra esta variante. Un ensayo de la vacuna de Johnson & Johnson mostró una eficacia del 57% en Sudáfrica, en comparación con una eficacia del 72% en Estados Unidos. Y un pequeño ensayo de la vacuna de AstraZeneca no logró demostrar la protección, lo que llevó a Sudáfrica a suspender el despliegue previsto de esta vacuna.
La vigilancia continua de las variantes del SRAS-CoV-2 y los ensayos clínicos en diferentes lugares del mundo ayudarán a identificar qué vacunas son más (o menos) eficaces contra las variantes del SRAS-CoV-2 y en qué lugares geográficos. Si surge una cepa variante capaz de evadir la inmunidad, puede ser necesario recibir un refuerzo dirigido a la variante. Con este fin, Moderna ya se ha comprometido a probar vacunas de segunda generación utilizando el ARNm de la espiga del SARS-CoV-2 con mutaciones de la cepa variante.
5. ¿Quién no debe vacunarse?
Actualmente, los niños menores de 16 años no deben ser vacunados. La única vacuna contra el COVID-19 disponible actualmente para los adolescentes es la de Pfizer/BioNTech, que está autorizada para personas de al menos 16 años. Todas las demás vacunas están autorizadas para adultos de 18 años o más. Se han iniciado ensayos clínicos que incluyen a niños, pero por ahora los menores de 16 años no deben ser vacunados con ninguna vacuna COVID-19.
La única contraindicación médica para la vacunación con COVID-19 es una reacción alérgica grave a una dosis de vacuna anterior o a cualquier componente de la vacuna (los ingredientes de las vacunas de ARNm pueden consultarse en los CDC). En el caso de las vacunas de ARNm, los antecedentes de alergia al polisorbato también se consideran una contraindicación debido a una respuesta inmunitaria cruzada con el polietilenglicol de la nanopartícula lipídica. Cualquier preocupación sobre la alergia a la vacunación debe ser discutida con un profesional de la salud.
Las precauciones para la vacunación pueden variar a nivel regional y difieren para cada vacuna. La Organización Mundial de la Salud sugiere que se retrase la vacunación en personas embarazadas o en periodo de lactancia, aunque otros organismos, como el Colegio Americano de Obstetras y Ginecólogos (ACOG), afirman que no debe evitarse la vacunación en personas embarazadas. Las consideraciones pueden incluir el riesgo de exposición, el nivel de COVID-19 en la comunidad, el riesgo y la gravedad de la COVID-19 materna, incluidos los riesgos para el feto, y la seguridad y eficacia de la vacuna. Las condiciones médicas que pueden justificar la precaución incluyen a las personas con inmunocompromiso, trastornos autoinmunes o antecedentes de síndrome de Guillain-Barré o parálisis de Bell. Las precauciones en la vacunación no son contraindicaciones; sin embargo, deben ser motivo de discusión con un profesional de la salud.
La vacunación también debe ofrecerse a las personas con antecedentes de COVID-19 confirmados, aunque esta orientación también puede diferir a nivel regional y depender del suministro de vacunas. Antes de la vacunación, las personas con un diagnóstico reciente de COVID-19 deben estar recuperadas de la enfermedad y cumplir todos los criterios para suspender el aislamiento. Se sugiere un aplazamiento de 90 días de la vacunación para los pacientes con COVID-19 que hayan recibido terapia de anticuerpos monoclonales o plasma de convalecencia como medida de precaución para evitar la posible interferencia relacionada con el tratamiento con la respuesta inmunitaria inducida por la vacuna.
No se recomienda la vacunación como profilaxis post-exposición para personas con una exposición conocida, ya que es poco probable que proporcione protección. Las personas con una exposición conocida a alguien con COVID-19 deben retrasar la vacunación hasta que termine el periodo de cuarentena para evitar una posible transmisión.
La orientación general es recibir cualquier vacuna contra el COVID-19 que esté disponible siempre que se ofrezca, mientras se continúa con el uso de mascarillas, el distanciamiento físico y el lavado de manos frecuente después de la vacunación. En la actualidad, no se recomienda ninguna vacuna específica sobre otra.
